Valugi, CC BY-SA 3.0 <https://creativecommons.org/licenses/by-sa/3.0>, via Wikimedia Commons
Por Rodrigo Ochoa, del Servicio Científico Técnico de Proteómica del IACS
Son características biológicas, bioquímicas o fisiológicas que puedan ser medidas y que nos ayudan a distinguir procesos fisiológicos normales, procesos patológicos (enfermedades) o los efectos producidos por una determinada sustancia (fármacos, tóxicos, etc.) en un organismo. Estos cambios fisiológicos pueden venir dados por pequeñas diferencias genéticas o en la composición de ciertas sustancias presentes en los tejidos o fluidos biológicos del organismo y sirven para ayudar a detectar qué personas son más propensas a desarrollar o sufrir una enfermedad, diagnosticar la misma, darnos pistas sobre la fase en la que se encuentra dicha enfermedad o el tratamiento más indicado en ese preciso momento, por ser el más eficaz o el que menos efectos secundarios presenta para el paciente.
Los biomarcadores ideales deberían tener las siguientes características:
- Específicos: nos permiten distinguir entre una enfermedad y otra; una persona sana de una enferma o clasificar a un paciente según ciertas diferencias.
- Sensibles: pequeños cambios en la cantidad medida en el laboratorio nos tendrán que permitir distinguir unas condiciones fisiológicas de otras.
- Predictivos: nos ayudan a intentar prever cómo cursará la enfermedad o qué pasará al tomar determinado fármaco.
- Rápidos: las pruebas con las que se detecta deberá poder hacerse en un tiempo adecuado para el uso clínico.
- Baratos de detectar: para que pueda implementarse su uso a la clínica de rutina, deberá de ser viable económicamente el uso masivo de estas pruebas.
- Estables: como la realización de las pruebas de laboratorio se demoran un tiempo desde la toma de la muestra, la molécula a determinar tendrá que ser estable in vitro.
- No invasivos: será preferible obtener la muestra mediante un pinchazo o un rascado celular que tomar biopsias.
Y, además de todas las cualidades anteriores, que tengan suficiente importancia clínica como para ser relevantes en la toma de las decisiones relativas al desarrollo de la enfermedad o la aplicación de unos tratamientos u otros.
Según los tipos de biomarcadores podemos distinguir entre biomarcadores moleculares, celulares y de imagen. Estos últimos, se basan en técnicas que visualizan los distintos órganos y aparatos del cuerpo como pueden ser la tomografía computarizada, la resonancia magnética, la tomografía por emisión de positrones, la radiografía convencional y el resto de modalidades radiológicas, por lo que son pruebas in vivo, que permiten visualizar la zona de interés del paciente en directo. Los biomarcadores moleculares, genéticos, celulares e histológicos suelen estudiarse in vitro mediante distintas técnicas de laboratorio.
Según su propósito, los biomarcadores pueden ser de susceptibilidad, si con su ayuda podemos determinar quién tiene más posibilidades de sufrir una determinada patología; diagnósticos, si nos permiten confirmar qué enfermedad padece un paciente; de seguimiento, los que nos dicen en qué etapa de la enfermedad o cómo está evolucionando el paciente; o predictivos, que nos ayudarán a prever la respuesta que tendrá un paciente a determinados fármacos, ayudando al médico a elegir el tratamiento de esta persona según el fármaco más eficaz y con menor toxicidad.
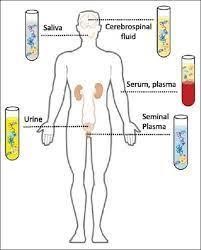 Para buscar biomarcadores biológicos se pueden utilizar todo tipo de muestras biológicas: sangre, plasma, suero, orina, saliva, líquido cefalorraquídeo, células, tejidos procedentes de biopsias, etc. Cuanto más fácil y barato; y menos cruento y doloroso sea la obtención de la muestra, más sencillo será implantarlo en la práctica clínica diaria en hospitales y demás centros sanitarios. Por eso son preferibles muestras fáciles de obtener, como la sangre y sus derivados (plasma y suero), la orina y la saliva.
Para buscar biomarcadores biológicos se pueden utilizar todo tipo de muestras biológicas: sangre, plasma, suero, orina, saliva, líquido cefalorraquídeo, células, tejidos procedentes de biopsias, etc. Cuanto más fácil y barato; y menos cruento y doloroso sea la obtención de la muestra, más sencillo será implantarlo en la práctica clínica diaria en hospitales y demás centros sanitarios. Por eso son preferibles muestras fáciles de obtener, como la sangre y sus derivados (plasma y suero), la orina y la saliva.
De cada uno de estos tipos de muestras biológicas se pueden analizar genes, ARN, proteínas, metabolitos, etc.
Aquí nos centraremos en las proteínas, que son macromoléculas compuestas de cadenas de aminoácidos. Las proteínas pueden combinarse con otros elementos, como metales (cobre, hierro, etc.), glúcidos o lípidos para formar compuestos heterogéneos y con una diversidad funcional increíble. Entre esta infinidad de funciones se encuentran: el transporte de sustancias como la hemoglobina que transporta oxígeno a todas nuestras células; funciones defensivas, como los anticuerpos, que nos protegen de enfermedades provocadas por microorganismos; funciones metabólicas o transformación de unas moléculas en otras, como las enzimas y toda una red de señalización entre los distintos tejidos del organismo que incluyen desde el mantenimiento de los niveles de glucosa correctos por parte de la insulina, hasta la regulación de la sensación de hambre por la leptina.
La mayoría de patologías tienen implicada alguna proteína, ya sea en la aparición de la enfermedad o en su posterior desarrollo: cáncer, Alzheimer, Parkinson, Esclerosis Lateral Amiotrófica, enfermedades autoinmunes, cardiovasculares, metabólicas, obesidad, déficits nutricionales, etc. Por lo que ampliar el conocimiento de la implicación de las proteínas en las distintas enfermedades es crucial para el establecimiento de los biomarcadores del futuro.
Los biomarcadores más comunes pueden ser los incluidos en los análisis de sangre rutinarios, como las lipoproteínas, colesterol, triglicéridos, vitaminas, hormonas, enzimas hepáticas, troponina, etc. (Al final del documento se adjunta una tabla con algunos de los biomarcadores más comunes en los análisis rutinarios). Pero para el futuro se espera poder predecir la propensión a padecer Parkinson o Alzheimer con un análisis de sangre (midiendo las proteínas amieloide y tau) o la probabilidad de padecer un evento cardiovascular según el equilibrio de algunas moléculas como las adipoquinas.
Recientemente, durante la pandemia de COVID19, hemos visto la importancia de las proteínas implicadas en el sistema inmune como biomarcadores en la salud a nivel global, realizándose estudios de seroprevalencia (medida del nivel de anticuerpos) en personas que habían pasado la enfermedad y en personas vacunadas para ver eficacia de la vacuna.
Los avances tecnológicos de las últimas décadas han dado lugar al desarrollo de varias disciplinas dentro del campo de la biología que se conocen como tecnologías ómicas:
- Genómica: estudio del ADN y sus mutaciones, los genes y la interacción entre ellos y su correlación con ciertas enfermedades.
- Transcriptómica: estudio de qué genes y en qué cantidad se están expresando en ese preciso momento.
- Proteómica: estudio de las proteínas y sus interacciones entre ellas y con otras sustancias del organismo.
- Lipidómica y metabolómica: estudio de los lípidos y otras pequeñas moléculas implicadas en las distintas reacciones bioquímicas de una célula o tejido.
- Nutrigenética y nutrigenómica: estudian los efectos de la dieta en cada paciente y qué alimentos son más convenientes para cada persona según su herencia genética.
- Microbiómica: estudia la interacción de los microorganismos que conviven en nuestro cuerpo con nuestras propias células y la implicación de los desequilibrios con ciertas patologías.
- Farmacogenómica y toxicogenómica: estudio de cómo afectan fármacos, tóxicos o drogas a cada individuo y la capacidad de cada persona de metabolizar las distintas sustancias.
- Bioinformática: el aprovechamiento de la ingente cantidad de datos que generan las disciplinas citadas anteriormente y muchas otras, no sería posible sin el tratamiento de estos datos por potentes ordenadores.
El desarrollo de las técnicas anteriores y su implantación en los sistemas de salud ha dado lugar a un nuevo concepto de medicina: la medicina personalizada.
Papel de los biomarcadores en la medicina personalizada
La medicina personalizada intenta aplicar a cada paciente un seguimiento y tratamiento de la enfermedad individualizada a su caso particular según los distintos factores que le afectan, tanto biológicos (enfermedad, gravedad, genes, etc.), como ambientales (estilo de vida, alimentación, acceso al sistema sanitario, etc.). Esta visión de la atención sanitaria permite dar la mejor solución posible a cada persona en cada momento e intentando evitar tratamientos fallidos, con la mejora que ello supone en la salud del paciente que no tiene que perder un tiempo precioso tomando medicamentos que no le funcionarán y podrían traerle efectos secundarios y, además, repercutiendo favorablemente en el sistema sanitario al ofrecer una mejor atención y ahorrando dinero, que de otra forma hubiera sido malgastado. Es interesante citar la existencia de ensayos que obtienen células del paciente para posteriormente cultivarlas in vitro y tratarlas con distintos fármacos para determinar a cuál va a responder mejor ese paciente en concreto (fármaco más eficaz y menos tóxico).
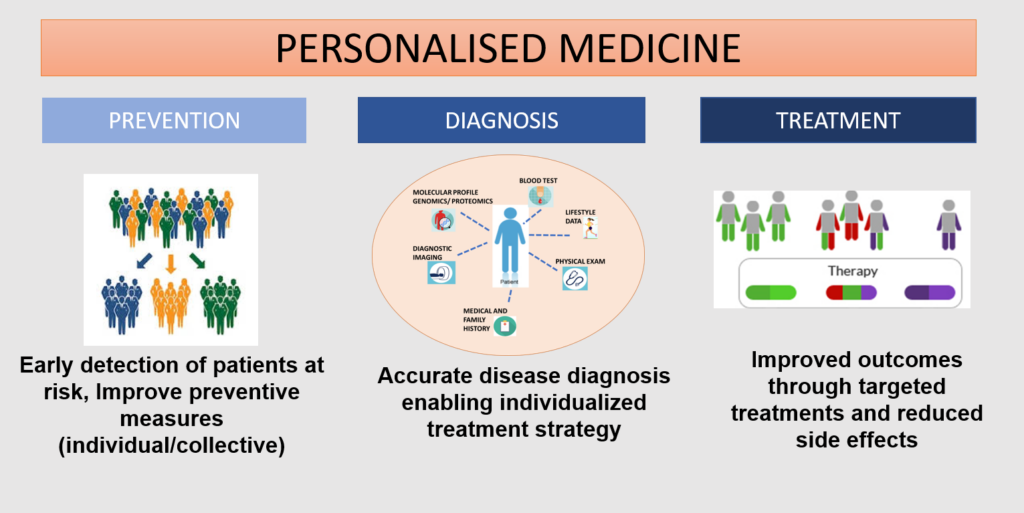
Fuente: Consorcio Medicina Personalizada EU-Latinoamérica y Caribe. https://www.eulac-permed.eu/
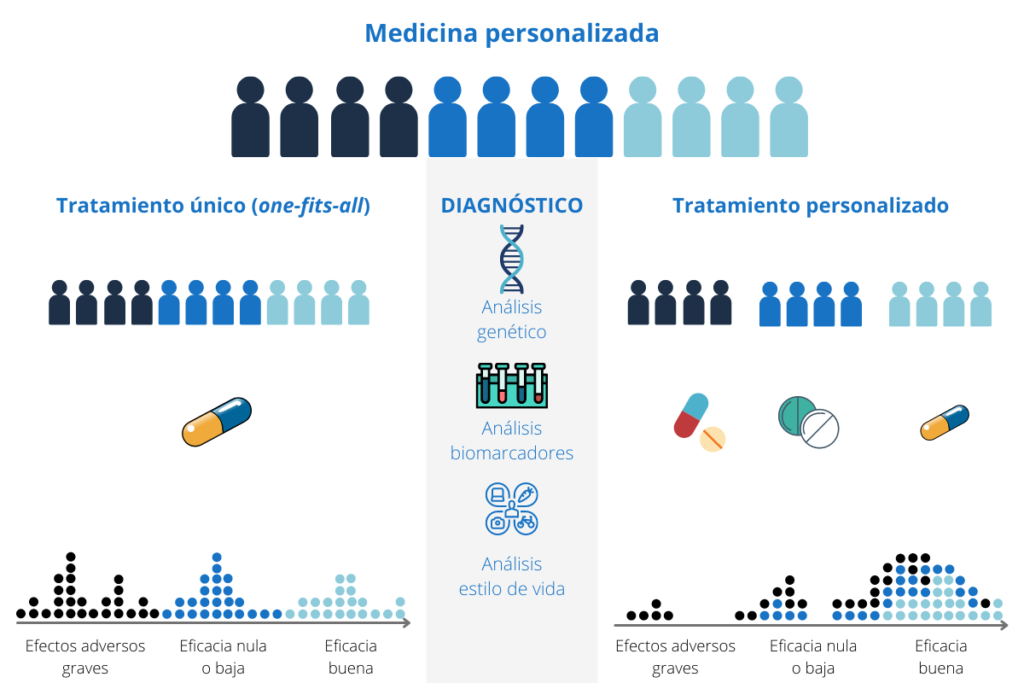
Fuente: Genosalut – Diagnóstico genético. https://www.genosalut.com/
Por último, queda citar algunos de los biomarcadores que se analizan en el Servicio Científico Técnico de Proteómica del IACS. Entre ellos, destacan los que ayudan al seguimiento de las llamadas enfermedades raras, patologías que son extremadamente infrecuentes, pero muy dañinas para la salud del paciente que las sufre. El LysoGB1 es un biomarcador de seguimiento para la enfermedad de Gaucher, una enfermedad rara congénita causada por el déficit de la enzima glucocerebrosidasa y cuyo déficit hace que se acumulen ciertos lípidos en algunos órganos como el hígado y el bazo. Otro biomarcador utilizado es el 7-keto colesterol, que se usa para el seguimiento de la enfermedad de Niemann-Pick. Esta patología, al igual que la anterior, cursa con un acúmulo de lípidos en hígado, bazo, pulmones e incluso cerebro. El análisis de estos biomarcadores es crucial para la correcta monitorización de los pacientes
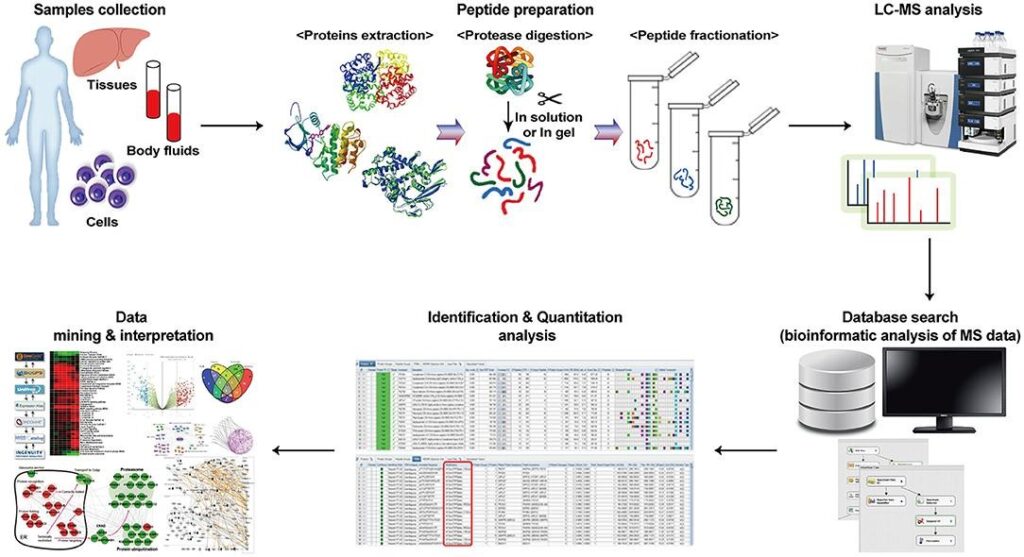
Application of Proteomics in Cancer: Recent Trends and Approaches for Biomarkers Discovery. Front. Med., 22 Septiembre 2021
Anexo I: Algunos de los principales biomarcadores utilizados en la clínica actual

Anexo II: Volante de petición de analítica




